Organi interi senza cellule, zucchero filato, polvere di staminali. Può sembrare la lista degli ingredienti che una strega tufferebbe nel suo calderone. E se invece fosse la ricetta del nuovo Dr. Frankenstein?
Una frase che sento pronunciare spesso, dentro il mio ambito lavorativo, è “la medicina rigenerativa è il futuro”. È detta con il suono di una profezia che confonde il possibile con il futuribile, visto che molto di quello che ci si immagina è già attuale. Le cellule staminali sono una concreta opportunità terapeutica già oggi, ma la rigenerazione cela il mito di trovare una soluzione per ogni male dell’uomo. La riparazione dei tessuti è un processo innato degli organismi e la ricerca punta ad estremizzarlo con l’obiettivo di curare tutte le patologie, invecchiamento compreso.
Non siamo che all’inizio di una rotta verso una meta tanto ambiziosa, ma se per molti la medicina rigenerativa è il futuro, vale la pena domandarsi quale sia il futuro della medicina rigenerativa.
Stampa 3D
La stampa 3D (o 3D printing) è una tecnologia popolare in moltissimi settori. È un metodo veloce, semplice e affidabile per realizzare oggetti tridimensionali a partire da un modello digitale. L’oggetto viene creato attraverso una produzione additiva, ovvero di costruzione strato dopo strato. La rivoluzione portata nel campo medico non riguarda solo la rigenerazione dei tessuti, ma anche la possibilità di modellare protesi a perfetta misura del paziente. Nella medicina rigenerativa, invece, la tecnologia del 3D printing può permettere di stampare organi interi oppure di stampare matrici di ricostruzione completamente autologhe.

La stampa di organi interi potrebbe cambiare radicalmente l’aspettativa di vita dei pazienti in attesa di un trapianto. Negli Stati Uniti sono circa 113’000 le persone in lista d’attesa (in Italia se ne registrano 8’615 a dicembre 2019) e circa 20 i decessi che ogni giorno si contano per mancanza di un donatore. Il 3D printing non si offre solo come alternativa, ma modella la propria soluzione direttamente sull’anatomia dei pazienti. L’inchiostro con cui vengono stampati è composto, di fatto, da polimeri e cellule. Le sfide in questo campo sono diverse, a partire dalla scelta del biomateriale, che deve essere perfettamente biocompatibile ma allo stesso tempo resistente, fino ad arrivare alla complessa geometria cellulare che compone i tessuti quasi impossibile da replicare artificialmente. Replicare la complessità di un cuore o un rene non è affatto una passeggiata, ma in alcuni casi il 3D printing è stato già utilizzato con successo per cambiare radicalmente il corso della vita di un uomo.
La stampa 3D autologa, invece, è una novità che ha lo scopo di produrre matrici con modalità additiva sfruttando come bio-inchiostro cellule ed elementi della matrice extracellulare di esclusiva origine autologa, ovvero del paziente stesso. Si tratta di matrici dermiche (anche se in futuro sarà applicabile anche per altri tessuti come l’osso e la cartilagine), costruite grazie al grasso del paziente che diventa, a tutti gli effetti, un bio-inchiostro. Sulla base di uno stampo modellato sulla scansione della ferita, vengono stampate la matrice extra-cellulare e le singole cellule in una procedura della durata di un semplice intervento chirurgico.
Decellularizzazione
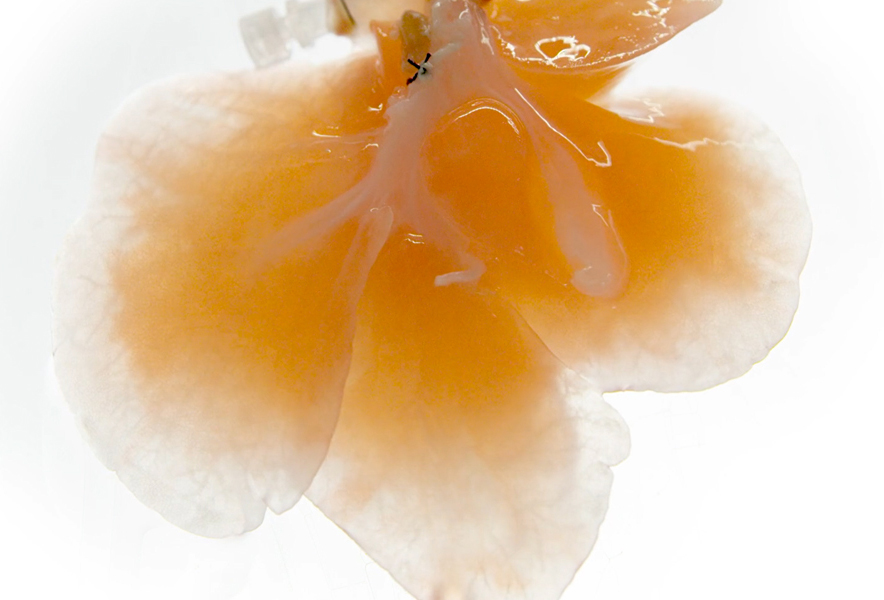
La decellularizzazione può essere vista come un concetto opposto alla stampa 3D perché fa vantaggio di una produzione sottrattiva anziché additiva. Apre un grande scenario nel mondo dell’ingegneria tissutale e, anche in questo caso, rivoluziona il concetto di trapianto. Si tratta dell’eliminazione completa delle cellule di un tessuto o di un organo attraverso metodiche enzimatiche o chimiche. Il prodotto finale è uno “scheletro” di sostegno dell’organo, composto in maniera esclusiva dalla matrice extracellulare. Un organo decellularizzato appare del tutto bianco/trasparente e agisce come perfetta guida per la ricostruzione del tessuto che avviene attraverso la perfusione di nuove cellule. Il vantaggio di sostituire le cellule di un organo con altre risiede nella possibilità di usare materiale di origine animale, più disponibile di quello umano, senza rischiare reazioni di rigetto.
Macchine per zucchero filato (sì, avete letto bene)

Nei trapianti un aspetto critico è la rivascolarizzazione. Un organo, per sopravvivere, ha bisogno di sangue e questo significa essere raggiunto da capillari, strutture dieci volte più piccole, in diametro, di un capello. Al momento, si tratta di una sfida impossibile per la stampa 3D. Una macchina per zucchero filato, però, può creare fibre di polimero molto sottili. Una volta ottenuta una massa di microfibre simile alla rete capillare, questa viene ricoperta da un hydrogel perfettamente biocompatibile e in grado di sostenere la rigenerazione tissutale. La massa di microfibre immersa nell’hydrogel è posizionata in un incubatore, dove una specifica temperatura permette la dissoluzione delle fibre, lasciando nello stampo di hydrogel il solco della ramificazione capillare.
Terapia cellulare
Le tecnologie trattate nei paragrafi precedenti riguardano il trapianto d’organo o di tessuto. Non sono adatte, però, a trattare una patologia complessa o sistemica, dove la sostituzione di una “parte” non è sufficiente alla risoluzione del problema. In questo caso entrano in gioco le singole cellule che possono essere iniettate localmente o essere veicolate attraverso il sangue, ingegnerizzate o semplicemente sfruttate per contrastare i meccanismi patologici.

La più grande rivoluzione nel settore della terapia cellulare è avvenuta grazie alla “scoperta” delle cosiddette iPSC (acronomico di induced Pluripotent Stem Cells), grazie a Shin’ya Yamanaka, Premio Nobel per la medicina nel 2012. È una tecnologia che permette di ottenere cellule staminali pluripotenti (e di conseguenza, attraverso il differenziamento, qualsiasi altra cellula adulta) a partire da una semplice cellula somatica del paziente. Ripetendo il concetto: prendi una cellula qualunque e la “trasformi” (termine sbagliatissimo nella biologia cellulare) in una cellula qualsiasi. Il ventaglio di possibilità che questa tecnologia offre è pressoché infinito, tanto da essere diventata uno strumento di largo consumo in moltissimi laboratori di ricerca. Inoltre, ha permesso di superare molti limiti di natura etica che emergevano con l’utilizzo delle cellule embrionali.
Utilizzare le cellule (staminali o non staminali), però, è complicato perché una loro manipolazione eccessiva le identifica alla stregua di un farmaco, da un punto di vista regolatorio. È la ragione per cui la realtà clinica, spesso, tiene lontane da sé le tecniche di laboratorio come la cultura cellulare, preferendo più sovente le terapie autologhe, dove il donatore coincide con il ricevente. Una nuova tecnologia, però, promette di utilizzare le cellule senza utilizzare le cellule: il secretoma. Qualcuno la definisce con toni fiabeschi “polvere di staminali”, ma non è altro che il contenuto di rilascio di una cellula staminale – il vero motivo per cui sono apprezzate a livello clinico. Fattori di crescita, proteine, acidi nucleici e altre sostanze utili alla rigenerazione vengono liofilizzati, in forma libera o dentro alle microvescicole, e resi pronti all’uso.
Infine, toccherebbe accennare alla terapia genica, anche se io l’ho rilegata ad un’altra rubrica. Spesso, però, la terapia cellulare e la terapia genica si sovrappongono diventando utili l’una all’altra.
Questo articolo ha evitato di approfondirsi, arrogandosi il diritto di fare una carrellata di nozioni una in pila all’altra, senza fronzoli di spiegazione. L’obiettivo, però, era quello di elencare il “cast” degli attori della medicina rigenerativa che promettono di stupirci negli anni avvenire. Forse il Dr. Frankestein, se fosse vissuto ai nostri tempi, avrebbe utilizzato questi ingredienti per creare il suo nuovo mostro, anziché parti di cadavere. Curiosamente, la sua creatrice Mary Shelley definiva Frankestein il Prometeo Moderno… piuttosto in linea con il nome della rubrica, non trovate?
Questo articolo fa parte della rubrica Il fuoco di Prometeo


